티스토리 뷰
목차
안녕하세요! 오늘은 HLB에서 개발 중인 간암 신약에 대해 이야기해볼게요. 최근 HLB가 FDA의 임상시험 현장 실사를 통과했다는 기쁜 소식이 있었죠. 이 내용이 간암 치료에 어떤 의미가 있는지, 그리고 HLB의 향후 계획에 대해서도 함께 살펴보도록 할게요.
HLB는 주로 항암제 개발로 알려진 제약회사로, 다양한 혁신적인 치료제를 연구하고 있습니다. 특히, 간암과 같은 난치병에 대한 신약 개발에 집중하고 있으며, 여러 국제 임상 시험을 진행하고 있습니다. HLB는 그동안 많은 연구 개발 성과를 내며 제약 업계에서 주목받고 있습니다.

FDA 임상시험 현장 실사란?
FDA 임상시험 현장 실사, 즉 BIMO(Bioresearch Monitoring) 실사는 신약 승인 과정에서 FDA가 수행하는 중요한 절차입니다. 이 실사는 임상시험의 진실성을 확인하기 위해 시험에 참여하는 병원과 임상시험 스폰서, 그리고 임상시험 수탁기관(CRO)을 FDA 심사관이 직접 방문하여 진행합니다. 실사를 통해 안전성과 유효성이 검증되는 것이죠.
HLB 간암 신약의 배경
HLB의 간암 신약 후보물질은 리보세라닙과 중국 항서제약의 면역항암제 캄렐리주맙의 병용 요법입니다. 이 조합은 최근 몇 가지 임상 시험에서 좋은 결과를 보였다고 알려져 있습니다. 간암은 치료가 어려운 질병으로, 새로운 치료 옵션은 많은 환자에게 희망이 될 수 있습니다.
FDA BIMO 실사 통과 소식
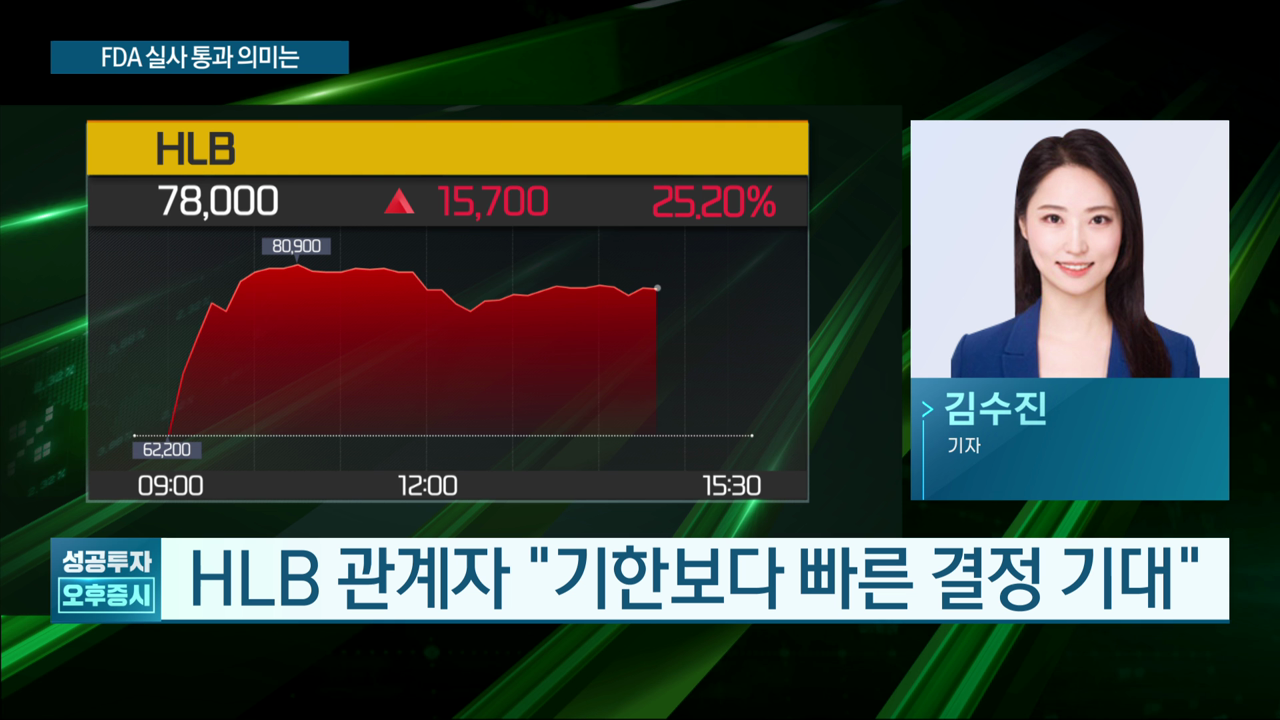
최근 HLB는 FDA의 BIMO 실사에서 '보완할 사항 없음(NAI)' 판정을 받았다고 발표했습니다. 이는 FDA가 HLB의 임상시험이 적절하게 진행되었다고 인정한 것이며, 임상시험의 신뢰성을 높여주는 좋은 소식입니다. HLB는 이 실사를 통과함으로써 신약 승인이 가까워졌다고 자신하고 있습니다.

HLB의 향후 계획과 기대
HLB는 이번 FDA의 긍정적인 결과를 바탕으로 신약 허가 신청을 준비하고 있습니다. 현재 HLB는 간암 치료 분야에서의 입지를 더욱 강화하고, 글로벌 시장으로의 진출을 목표로 하고 있습니다. 이러한 변화는 많은 환자들에게 새로운 치료 기회를 제공할 수 있을 것입니다. HLB의 주가는 이번 소식으로 인해 큰 폭으로 상승했으며, 앞으로의 전망도 밝습니다.
결론 및 요약
HLB의 간암 신약이 FDA의 임상시험 현장 실사를 통과했다는 것은 매우 중요한 이정표입니다. 이는 HLB가 신약 승인 과정에서 긍정적인 평가를 받았음을 의미하며, 앞으로의 연구 개발에 더욱 박차를 가할 수 있는 계기가 될 것입니다. 환자들에게 더 나은 치료 옵션을 제공하기 위한 HLB의 노력에 많은 기대가 모아지고 있습니다.
관련 링크 및 추가 자료
- HLB 간암 신약 후보물질, 美FDA 현장 실사 통과 (코메디닷컴)
- HLB, '리보세라닙' FDA BIMO 실사 "통과" (바이오스펙테이터)
- HLB 간암신약, FDA 임상시험 현장 실사 통과... “허가 가시권" (조선일보)
이 포스팅을 통해 HLB의 간암 신약에 대한 기대감이 더욱 커지길 바라며, 앞으로의 진행 상황도 지속적으로 확인해보세요!


태그
#HLB #간암신약 #FDA #임상시험 #BIMO #신약승인 #암치료 #제약회사 #리보세라닙 #캄렐리주맙 #임상병원
이런 자료를 참고 했어요.
[1] 데일리팜 - HLB "신약 임상병원 FDA 실사 통과…허가 가시권" (https://www.dailypharm.com/Users/News/NewsView.html?ID=317615)
[2] 코메디닷컴 - HLB 간암 신약 후보물질, 美FDA 현장 실사 통과 (https://kormedi.com/1737659/)
[3] 바이오스펙테이터 - HLB, '리보세라닙' FDA BIMO 실사 "통과" (http://www.biospectator.com/view/news_view.php?varAtcId=23596)
[4] 조선일보 - HLB 간암신약, FDA 임상시험 현장 실사 통과... “허가 가시권 ... (https://www.chosun.com/economy/science/2024/11/18/FSD2B2JL4PK2QESBZRKFE6YC5Q/)

